Химия и Химики № 1 2018
Журнал Химиков-Энтузиастов
| Оглавление | Видео опыты по химии | Видео опыты по физике | На главную страницу |
|
Химия и Химики № 1 2018 Журнал Химиков-Энтузиастов |
 |
Медь и кислоты - ч.1 Copper and acids В.Н. Витер |  |
|
Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Растворяется ли медь в соляной кислоте?
Does copper dissolve in hydrochloric acid? № 8 (2009)
Ответ, казалось бы, очевиден: в любом учебнике написано, что медь не растворяется в соляной кислоте. Объясняют это просто: металлы, которые расположены в электрохимическом ряду напряжений правее водорода, не могут вытеснять его из кислот. Другими словами, если анион кислоты не проявляет окислительных свойств, медь в таких кислотах растворяться не должна. Но химия – наука экспериментальная. Химики ничего не принимают на веру. Проведем эксперимент. Возьмите кусочки медной проволочки или медную стружку. В случае необходимости освободите поверхность металла от лака, потом быстро промойте его разбавленной азотной кислотой и много раз - водой. Для чистоты эксперимента можно залить медь на несколько минут концентрированной соляной кислотой, а потом сполоснуть большим количеством воды – так мы будем точно уверены, что налет оксида полностью удален с поверхности меди. Теперь положим по 5-10 гр проволочек в две одинаковые бутылочки на 50 мл. В первую бутылочку налейте доверху концентрированную HCl [1] и плотно закройте ее пробкой – чтобы внутри практически не осталось воздуха. Во вторую бутылочку налейте до половины соляной кислоты и накройте ее неплотным ватным тампоном. |

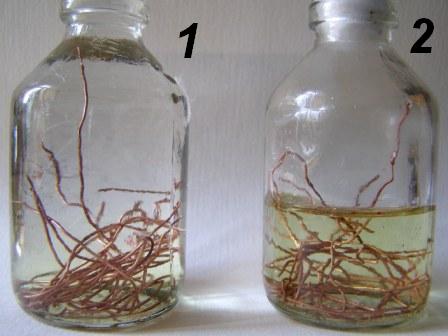
Две бутылочки с медной проволокой заполним концентрированной соляной кислотой. Первая бутылочка полная и плотно закрыта, вторая наполнена лишь наполовину и накрыта ватным тампоном, который пропускает воздух
|
|
В обеих бутылочках раствор быстро станет желтоватым. Теперь оставим бутылочки в укромном месте. Вторую (наполовину заполненную) бутылочку желательно время от времени встряхивать. Уже через полчаса разница станет очевидной. В первой (полной) бутылочке раствор так и останется желтоватым – в ней реакция практически не идет, зато во второй бутылочке раствор станет интенсивно-желтым, причем со временем его окраска будет усиливаться. Важное наблюдение: ни в одной из бутылочек газ не выделяется. Оставим бутылочки на пару дней (не встряхивая). Результат будет неожиданным: в первой (полной) бутылочке раствор обесцветится, а во второй разделится на два слоя: верхний – желто-коричневый и нижний – почти бесцветный. |


Уже через полчаса раствор во второй бутылочке станет интенсивно-желтым, в первой (плотно закрытой) бутылочке жидкость останется слегка желтоватой
|


Через два дня бледно-желтый раствор в закрытой бутылочке обесцветится.
В бутылочке, которая накрыта ватой, раствор разделится на два слоя |
|
Теперь попробуем разобраться, что произошло. Для начала несколько капель желто-коричневого раствора прибавим к избытку аммиака. Жидкость станет синей – значит, в нашем растворе присутствует медь: Cu2+ + 4NH3 = [Cu(NH3)4]2+ (синий) Полученный синий раствор не выливайте – он нам еще пригодится в конце опыта. |
 
Желтый раствор из верхней части второй бутылочки добавим к избытку аммиака. Раствор аммиака станет синим, что доказывает присутствие меди
|
|
Обычно растворы солей меди окрашены в голубой (или синий) цвет, почему же наш раствор желто-коричневый? Дело в том, что голубая окраска обусловлена присутствием гидратированных катионов [Cu(H2O)n]2+. Разбавленные растворы хлорида меди CuCl2 голубые. Но в крепких растворах соляной кислоты хлорид меди (II) образует комплекс коричневого цвета: CuCl2 + 2HCl <= > H2[CuCl4] Другими словами, хлорид ионы вытесняют молекулы воды из внутренней координационной сферы. Если раствор H2[CuCl4] разбавить водой, произойдет обратный процесс – молекулы воды вернутся во внутреннюю координационную сферу катионов меди, и раствор станет сначала зеленым, а затем голубым. В отсутствие соляной кислоты в крепких растворах CuCl2 также образуется комплекс [CuCl4]2-, причем в его внешней координационной сфере находятся ионы меди: 2CuCl2 <=> Cu[CuCl4] Многие переходные металлы ведут себя аналогично: железо, кобальт, никель, цинк, серебро, золото, платиновые металлы способны давать хлоридные комплексы. Вспомните, что при растворении золота в царской водке образуется золотохлороводородная кислота H[AuCl4]. Какие можно сделать выводы? В присутствии воздуха медь растворяется в соляной кислоте с образованием хлорида меди (II), водород при этом не выделяется. В отсутствии воздуха реакция не идет. Не трудно догадаться, что кислород воздуха играет роль окислителя: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O Формально эту реакцию можно рассматривать как совокупность двух стадий: 2Cu + O2 = 2CuO CuO + 2HCl = CuCl2 + H2O однако, реальный механизм этого процесса совсем другой. Кроме того, в крепких растворах HCl хлорид меди переходит в комплекс [CuCl4]2-. Таким образом, медь действительно не реагирует с соляной кислотой в отсутствии окислителей, но чего стоит это утверждение на практике? Ведь мы окружены атмосферой, а роль окислителя вполне успешно играет кислород воздуха – даже при комнатной температуре. А что будет, если использовать более сильный окислитель? Чтобы ответить на этот вопрос, автор взял первую бутылочку с медной проволокой (в которой реакция не пошла), вылил из нее две трети соляной кислоты, чуть разбавил оставшуюся кислоту водой и добавил 5 мл 30%-й перекиси. Раствор сразу же стал желто-зеленым, начал выделятся газ. Через несколько секунд реакция резко ускорилась, а через минуту почти все содержимое выплеснулось наружу - внутри бутылочки осталось немного почти черного раствора хлорида меди (II): Cu + 2HCl + H2O2 = CuCl2 + 2H2O Поняв свою ошибку, автор стал добавлять перекись водорода и соляную кислоту небольшими порциями. В результате вся медная проволока быстро растворилась. Образовался зеленовато-коричневый раствор CuCl2 (вернее - H2[CuCl4]). Приведенным способом можно легко растворить медь не имея азотной или концентрированной серной кислоты. |
 
Растворение меди в смеси HCl + H2O2 |
|
Теперь нам остается объяснить два факта: почему в отсутствии воздуха желтоватый раствор в первой бутылочке обесцветился и почему раствор во второй (неплотно закрытой) бутылочке разделилась на два слоя: верхний желто-коричневый и нижний бесцветный. Дело в том, что хлорид меди (II) при контакте с металлической медью переходит в бесцветный хлорид меди (I): CuCl2 + Cu = 2CuCl Хлорид меди (I) плохо растворим в воде, но за счет комплексообразования с HCl он остается в растворе: CuCl + HCl < = > H[CuCl2] Таким образом, в первой бутылочке сначала образовалось немного желтого H2[CuCl4] (под действием растворенного кислорода), но потом он прореагировал с металлической медью и перешел в бесцветный H[CuCl2]. Во второй бутылочке раствор свободно контактировал с воздухом. В ней протекали две противоположные реакции. В нижнем слое жидкости H2[CuCl4] восстанавливался металлической медью до H[CuCl2], а возле поверхности раствора происходил обратный процесс: H[CuCl2] окислялся кислородом до H2[CuCl4]. 4H[CuCl2] + 8HCl + O2 = > 4H2[CuCl4] + 2H2O |
 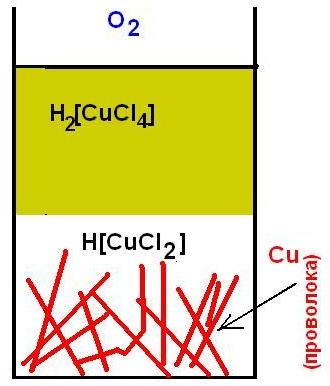 WIDTH="336" HEIGHT="246"
WIDTH="336" HEIGHT="246"
Медная проволока в концентрированном растворе соляной кислоты |
|
В системе установилось динамическое равновесие между Cu(II) и Cu(I), которое легко нарушить. Если плотно закрыть бутылочку, то кислород в ней постепенно израсходуется, и медь в растворе перейдет в бесцветный комплекс H[CuCl2]. Если же наоборот открыть ватный тампон и встряхивать содержимое (а еще лучше – барботировать через раствор воздух), то медная проволока со временем растворится с образованием окрашенного H2[CuCl4]. На этом и основан механизм растворения меди в соляной кислоте в присутствии воздуха. Сначала под действием кислорода медь окисляется, образуя немного оксида Cu2O. Оксид растворяется в кислоте и переходит в хлоридный комплекс меди (I) - H[CuCl2], который под действием кислорода превращается в H2[CuCl4]. Последний восстанавливается медью до H[CuCl2]. Медь при этом растворяется. Кислород воздуха снова окисляет H[CuCl2] до H2[CuCl4] и процесс повторяется до тех пор, пока не закончится один из реагентов. Помните, в самом начале мы отобрали немного желто-коричневой жидкости из второй бутылочки и подействовали на нее избытком аммиака? Надеюсь, вы не вылили полученный синий раствор. А теперь посмотрите на интенсивность его окраски и вспомните, каким был раствор сначала – сразу же после смешивания пробы с аммиаком. Нетрудно заметить, что окраска синего раствора со временем стала более интенсивной (см. фотографии). Это обусловлено тем, что в растворе одновременно присутствовали Cu(I) и Cu(II). Одновалентная медь образует с аммиаком бесцветный комплекс [Cu(NH3)2](OH), который при стоянии на воздухе окисляется до синего [Cu(NH3)4](OH)2 и интенсивность окраски раствора возрастает. После экспериментов у нас остался солянокислый раствор хлорида меди (II). Сохраните его: раствор пригодится для последующих экспериментов. Из следующей статьи мы узнаем о получении солей одновалентной меди. |


В пробирку с аммиаком добавили несколько капель раствора, полученного действием конц. HCl на медь в присутствии воздуха. При стоянии окраска синего раствора значительно усилилась
|
_chloride-sulfate-phosphate-1.jpg) |
Медь и кислоты - ч.2 Copper and acids В.Н. Витер | _chloride-sulfate-phosphate-2.jpg) |
|
Хлорид, сульфат и фосфат одновалентной меди Copper (I) chloride, sulfate and phosphate
Хлорид меди (I) CuCl
Как было сказано в предыдущей статье, при реакции металлической меди с хлоридом меди (II) в соляной кислоте образуется растворимый комплекс одновалентной меди H[CuCl2]. Выделить CuCl из такого раствора очень просто – достаточно разбавить его большим количеством воды. В результате комплекс разрушится, и хлорид меди (I) выпадет в виде белого осадка. На дно колбы насыпьте кусочки медной проволоки (очищенные от лака) или медную стружку. Залейте медь солянокислым раствором CuCl2, который мы получили в прошлом эксперименте (растворение меди в смеси HCl + H2O2). Неплотно накройте колбу стеклянной пробкой и поставьте ее нагреваться на электрическую плитку. Отрегулируйте нагрев так, чтобы жидкость слегка кипела. |
_chloride-sulfate-phosphate-3.jpg)
_chloride-sulfate-phosphate-4.jpg)
_chloride-sulfate-phosphate-5.jpg)
Реакция меди с солянокислым раствором CuCl2 |
|
Буквально через несколько минут станет заметно, что раствор бледнеет. При дальнейшем кипячении раствор обесцветится. CuCl2 + Cu = 2CuCl CuCl + HCl < = > H[CuCl2] Для того чтобы сместить равновесие последней реакции в лево, вылейте содержимое колбы в стакан с большим количеством воды [2]. Перед экспериментом воду желательно прокипятить и охладить в условиях минимального контакта с воздухом. Это необходимо, чтобы уменьшить окисление одновалентной меди. |
_chloride-sulfate-phosphate-6.jpg) _chloride-sulfate-phosphate-7.jpg) _chloride-sulfate-phosphate-8.jpg) _chloride-sulfate-phosphate-9.jpg)
Осаждение CuCl |
|
В результате содержимое колбы станет молочно-белым, а через несколько минут выпадет осадок. Декантрируйте (слейте) раствор с осадка, добавьте в колбу небольшое количество дистиллированной воды и быстро перенесите содержимое колбы на фильтр. После того, как раствор отфильтруется, полезно промыть продукт спиртом или ацетоном – это уменьшит окисление. Сушить хлорид меди CuCl можно только в отсутствии воздуха – в мокром виде он легко окисляется. Но для некоторых экспериментов фильтровать CuCl совсем не обязательно – можно использовать его суспензию в воде. К суспензии хлорида меди добавьте раствор едкого натра. Образуется желтый осадок гидроксида меди (I) CuOH: CuCl + NaOH = CuOH + NaCl Если стакан слегка подогреть на плитке, осадок станет красно-коричневого цвета – в результате образования Cu2O: 2CuOH = Cu2O + H2O |
_chloride-sulfate-phosphate-10.jpg)
CuOH |
_chloride-sulfate-phosphate-11.jpg)
Cu2O |
|
Теперь к суспензии хлорида одновалентной меди добавьте раствор аммиака. Осадок растворится, раствор станет слегка синим. Но уже через несколько минут окраска раствора будет темно-синей.
|
_chloride-sulfate-phosphate-12.jpg)
_chloride-sulfate-phosphate-13.jpg)
Взаимодействие CuCl с раствором аммиака |
|
На воздухе влажный CuCl быстро окисляется, в результате белый осадок становится голубым и зеленым.
|
_chloride-sulfate-phosphate-14.jpg)
Окисление влажного CuCl на воздухе |
|
В руководстве по препаративному неорганическому синтезу Г. Брауэра (т. 4) [ссылка] дано несколько способов получения хлорида меди (I) и описаны его основные свойства: Способ 1 _chloride-sulfate-phosphate-15.jpg) В нагретый до 60-70 °C теплый водный раствор, содержащий 50 г CuSO4•5H2O и 24 г хлорида натрия, пропускают газообразный SO2 до тех пор, пока количество выпадающего CuCl не будет больше увеличиваться. Осадок отфильтровывают, отделяют с отсасыванием, для очистки снова растворяют в конц. HCl, разбавляют водой, затем декантируют и наконец на фильтре промывают ледяной уксусной кислотой и обезвоженным эфиром. Соль высушивают при 110°С и хранят, исключив доступ воздуха и влаги. Способ 2 К кипящему раствору Cu(CH3COO)2 в ледяной уксусной кислоте, содержащей по крайней мере 50 об. % уксусного ангидрида, добавляют по каплям ацетилхлорид до тех пор, пока окраска не станет желтой. После 15 мин кипячения с обратным холодильником вещество на дне становится чисто-белым. Его фильтруют с отсасыванием, промывают ангидридом уксусной кислоты и сушат при 140-150°С. Другие способы 3. Нагревание CuCl2 с глицерином до 150-200°С. Образовавшийся CuCl отфильтровывают, промывают спиртом и сушат в вакууме. 4. Восстановление CuCl2•2Н2O раствором Na2SO3. 5. Восстановление CuCl2 с помощью N2H4•H2O. 6. Восстановление CuCl2•2Н2O электролитической медью в кипящей HCl. После разбавления раствора водой при полном отсутствии воздуха выкристаллизовывается CuCl (этот способ был рассмотрен выше – прим. ред.) 7. Сублимация продажного CuCl в потоке HCl или Ar над Cu при 900 °С Свойства. M 98,99. Белый кристаллический порошок. tПл 430 °С; tКип 1490 °С; d 4,41 (25 °С), 3,677 (422 °С). Кристаллическая структура типа цинковой обманки (пр. гр. F43m; а=5,416 А). При 407°С превращается в высокотемпературную модификацию типа вюртцита (пр. гр. Р63mc; а=3,91 А, с=6,42 А). Энтальпия образования H0298 -138,1 кДж/моль. Мало растворяется в воде (частично разлагается: 2CuCl =>Cu + CuCl2). На воздухе образуются зеленые основные хлориды. Растворяется в горячей конц. HCl, в концентрированных растворах щелочей и аммиака. |
|
Сульфат меди (I) Cu2SO4
Сначала попробуем получить сульфат одновалентной меди аналогично хлориду. Для этого в колбочке прокипятите кусочки медной проволочки с раствором CuSO4, подкисленным серной кислотой. Легко убедиться, что никакой реакции не происходит – даже при длительном нагревании. Попытки получить Cu2SO4 из хлорида или иодида одновалентной меди также не принесут успеха. Для синтеза Cu2SO4 используют взаимодействие меди с концентрированной серной кислотой при 200°С. Если мы не ставим задачи препаративного получения Cu2SO4, то температуру контролировать не обязательно – достаточно нагреть кислоту до образования белых паров. Итак, налейте в колбочку 15-20 мл конц. H2SO4, неплотно накройте ее стеклянной крышкой, и нагрейте на песчаной бане до образования белых паров. Теперь аккуратно небольшими порциями бросайте в нее кусочки медной проволоки. Добавление меди вызовет активное выделение газа и образование тумана. Жидкость в колбе станет темно-зеленой, постепенно выпадет серый осадок. Это и есть сульфат одновалентной меди. Когда выделение газа ослабеет, охладите колбу и осторожно слейте раствор с осадка. В колбу аккуратно (опасайтесь брызг кислоты!) добавьте 20 мл воды. Раствор станет голубым, серый осадок Cu2SO4 постепенно (через несколько минут) превратится в красноватый осадок меди: Cu2SO4 => Cu + CuSO4 В результате разложения осадка голубая окраска раствора будет постепенно усиливаться. Если необходимо выделить Cu2SO4 в чистом виде, темно-зеленый раствор, полученный в результате растворения меди в кислоте, по каплям приливают к метанолу или смеси спирта с эфиром (1 : 1). Осадок промывают спиртом и сушат в вакууме. Свойства. Почти белые кристаллы или серо-белый порошок, d 3,605 (25 °С). Водой разлагается с образованием CuSO4 и Cu; устойчив на сухом воздухе. Медленно разлагается во влажном воздухе. Легко разлагается при нагревании. При 200°С окисляется с образованием CuO и CuSO4. Энтальпия образования H°298 -749,7 кДж/моль. |




Реакция меди с концентрированной серной кислотой с образованием Cu2SO4 |

Разложение осадка сульфата одновалентной меди при действии воды (В колбе также видны остатки медной проволоки) |
|
Фосфат меди (I)
Теперь попробуем получить фосфат одновалентной меди с помощью восстановления фосфорнокислого раствора Cu (II) металлической медью. Для этого растворим в фосфорной кислоте основный карбонат меди – до синей окраски раствора, добавим обрезки медной проволоки и нагреем раствор. Легко убедиться, что реакция не идет. Вероятно, фосфат одновалентной меди можно получить каким-то другим методом? Ведь Cu2SO4 тоже не образуется при восстановлении CuSO4, зато его можно легко синтезировать с помощью реакции металла с кислотой. Но в случае фосфата все гораздо сложнее – ортофосфат меди (I) синтезировать так и не удалось. Медь (I) в присутствии анионов фосфата становится нестабильной: она должна либо окислиться до Cu(II), либо восстановиться до металла. Фосфат и одновалентная медь могут одновременно присутствовать в растворе только тогда, когда Cu(I) образует прочные комплексы с другими лигандами. Мой коллега потратил полгода аспирантуры на попытки синтезировать фосфат меди (I), но никакие ухищрения не принесли успеха. Однажды он растворил CuCl в фосфорной кислоте и при охлаждении получил прозрачные игольчатые кристаллы. Кристаллы содержали медь, но совсем не содержали фосфора. Не трудно догадаться, что это был CuCl. Оказывается, что хлорид меди (I) можно переосаждать не только из соляной кислоты, но и из фосфорной. Группа авторов пыталась восстановить твердый Cu3(PO4)2 металлической медью при нагревании, но реакции не наблюдалось. В литературе описан метафосфат меди (I) - CuPO3, который образуется из Cu3(PO4)2 при высоких температурах. Однако существование CuPO3 как индивидуального вещества вызывает большие сомнения. Скорее всего, это стеклообразный продукт или сложная смесь. Получено несколько двойных фосфатов, которые содержат медь (I) и поливалентный катион, например, CuIM2(PO4)3, (где M = Ti, Sn, Zr). |
_chloride-sulfate-phosphate-16.jpg)
|
 |
Медь и кислоты - ч.3 Copper and acids В.Н. Витер |  |
|
Растворяется ли медь в разбавленной серной кислоте?
Does copper dissolve in dilute sulfuric acid? В любом учебнике можно прочитать, что медь не реагирует с разбавленной серной кислотой. Сомневаться в этом утверждении нет причин: ведь медь расположена в ряду напряжений правее водорода, а в разбавленных растворах анион сульфата окислительных свойств не проявляет. Другими словами, в разбавленном растворе H2SO4 нет окислителя, который мог бы окислить металлическую медь. Так ли это? Проведем простой эксперимент. Кусочки медной проволочки освободите от лака, промойте азотной кислотой (чтобы удалить оксид меди), после этого сполосните водой. Теперь поместите проволочки в стакан с разбавленной серной кислотой. Мы взяли раствор, приготовленный из 5 мл концентрированной H2SO4 и 20 мл воды [3]. Оставьте стакан в укромном месте и время от времени наблюдайте за изменениями. |


Медь в разбавленном растворе серной кислоты. Слева - через 1 сутки, справа через 2 суток |
|
Через сутки ничего не произошло - раствор так и остался бесцветным, а медная проволока - без видимых изменений. Значит, медь действительно не растворяется в разбавленной серной кислоте? Не будем спешить с выводами. Уже на второй день раствор стал слегка голубоватым, а на пятый день - интенсивно-голубым.
|


Медь в разбавленном растворе серной кислоты через 5 суток (слева) и через 10 суток (справа) |
|
Теперь проделаем аналогичный эксперимент в плотно закрытой колбе, доверху заполненной жидкостью. Сколько бы мы не ждали, раствор так и останется бесцветным. Вывод очевиден: медь в присутствии воздуха постепенно растворяется в разбавленной H2SO4, причем кислород играет роль окислителя: 2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O Способность серной кислоты растворять медь в присутствии воздуха не является чем-то экзотическим. Именно так в промышленности и получают медный купорос. В башни загружают гранулированную медь, сверху башня орошается разбавленной серной кислотой, а снизу подается воздух. Растворение меди происходит через промежуточное образование Cu2O и Cu2SO4 [4]. Использование кислорода в качестве окислителя позволяет экономить серную кислоту. Как мы убедились, в присутствии воздуха медь растворяется в разбавленной серной кислоте. Провести эту реакцию очень просто. Более того – она имеет большое промышленное значение. Почему же в школьных учебниках нет ни слова о растворении меди в кислотах-неокислителях, ведь это совсем не экзотика? Авторы учебников пытаются подогнать материал под упрощенные, наперед заданные схемы, а если какие-то вещества или реакции в эти схемы не вписываются - их просто игнорируют. Это касается не только экзотических случаев, но и очень важных для практики веществ или реакций. Многие способы получения веществ, которыми пользуются химики (в лаборатории или на производстве), разительно отличаются от того, что пишут в учебниках. И наоборот, некоторые вещества, упомянутые в учебниках и задачниках, в действительности просто не существуют. Далеко не все авторы учебников (а также большинство учителей и преподавателей) знают, что такое химия на практике. Вот и получается, что из года в год учебники переписывают под копирку, причем каждая следующая копия хуже предыдущей. С другой стороны, химики-практики редко занимаются педагогикой. В результате ученики и студенты могут научиться писать «схемы превращений» веществ, прекрасно решать задачи, но не иметь понятия, что такое химия. Проблема эта объективна и выход из нее один – заниматься самообразованием и как можно больше общаться с другими химиками. |




Кристаллы медного купороса |
 |
Медь и кислоты - ч.4 Copper and acids В.Н. Витер |  |
|
Как растворить медь не имея кислоты.
How to dissolve metallic copper without acids Растворение меди в смеси аммиак - перекись водорода На дно стаканчика на 100 мл насыпьте кусочки медной проволоки. Залейте медь концентрированным раствором аммиака. Жидкость станет слегка синей. Добавьте примерно сколько же воды. После этого по каплям добавляйте 30%-й раствор перекиси водорода (раствор перекиси лучше развести в 2-3 раза). Можно брать и аптечный 3%-й H2O2 или гидроперит. |

К меди добавим раствор аммиака, затем - перекись водорода |
|
Раствор вскипит от интенсивного выделения газа и станет темным. Стаканчик заметно нагреется. В момент добавления перекиси четко заметно образование коричневого продукта. Со временем содержимое стаканчика разделится на коричнево-зеленый осадок и темно-синий раствор. Добавляйте в раствор новые порции пероксида и аммиака. Медные проволочки будут постепенно растворяться. Через несколько часов коричнево-зеленый осадок полностью исчезнет. Вероятно, коричнево-зеленый продукт представляет собой соединение трехвалентной меди или пероксидное производное. В любом случае, подобные соединения неустойчивы, особенно в присутствии аммиака (восстановитель). На следующий день в стаканчике останется только синий раствор и немного голубого осадка. |

Со временем содержимое стаканчика разделится на коричнево-зеленый осадок и темно-синий раствор (1), при стоянии этот осадок полностью разложится (2, 3). В результате упаривания раствора образуется зеленовато-синий продукт (4) |
|
Слейте раствор с остатков нерастворившейся меди и дайте ему испариться при комнатной температуре. В результате образуется зеленовато-синий продукт.
Растворение меди в хлориде железа (III) FeCl3
Травление меди раствором хлорида железа (III) применяют при обработке плат. Это традиционный метод, которым часто пользуются в домашних условиях. В стаканчик поместите кусочки медной проволоки и залейте ее крепким раствором FeCl3. Автор использовал насыщенный раствор, который образовался в результате хранения хлорида железа (III) в неплотно закрытой банке (FeCl3 очень гигроскопичен). Оставьте раствор на несколько дней. Видимых изменений не произойдет – жидкость так и останется темной, однако значительная часть меди растворится. 2FeCl3 + Cu = 2FeCl2 + CuCl2 |

Под действием FeCl3 медь переходит в раствор (справа показана качественная реакция с NH3) |
|
Это легко доказать, если несколько капель раствора добавить в стаканчик с избытком аммиака. Раствор аммиака станет синим (не перемешивайте содержимое стаканчика, иначе образуется суспензия Fe(OH)3 и жидкость будет непрозрачной). А нельзя ли ускорить растворение меди? Для этого необходимо перемешивать раствор и повысить его температуру. Повышение температуры не только ускоряет реакцию, но и в несколько раз увеличивает растворимость хлорида железа (III) – при нагревании можно использовать более крепкие растворы травителя, а значит и более активные. В нашем эксперименте при температуре 60°С пучок медных проволочек растворился в хлориде железа примерно за 30 мин. Но с нагревом главное не переборщить, иначе произойдет гидролиз FeCl3. В результате образуются основные соли, которые не проявляют активности. Условно этот процесс можно выразить уравнениями: FeCl3 + H2O <=> FeCl2(OH) + HCl FeCl3 + 2H2O <=> FeCl(OH)2 + 2HCl. Хлороводород, который образуется в результате гидролиза, постепенно испаряется, равновесие реакции сдвигается вправо и процесс растворения меди может прекратиться. Поэтому не рекомендуется греть раствор хлорида железа выше 60°С.
Растворение меди в смеси сульфата меди и хлорида натрия (CuSO4 + NaCl)
Из предыдущих статей мы узнали, что медь растворяется в водном CuCl2, особенно – при нагревании. Непосредственным окислителем меди служит анион [CuCl4]2-: Cu2+ + 4Cl- <=> [CuCl4]2- [CuCl4]2- + Cu => 2[CuCl2]- 4[CuCl2]- + 4H+ + O2 + 8Cl- => 4[CuCl4]2-+ 2H2O и т.д. К сожалению, хлорид меди не является доступным веществом, но его можно заменить смесью сульфата меди и хлорида натрия (поваренной соли). |

Растворение меди в смеси CuSO4 и NaCl |
|
На дно стаканчика на 50 мл положите медную проволоку. Сверху насыпьте несколько чайных ложек медного купороса и примерно такое же количество хлорида натрия (по объему). Смочите вещества водой, чтобы раствор превратился в жидкую кашу. Содержимое стаканчика перемешайте (при этом раствор станет зеленым) и поставьте греться на песочную баню. Желательно, чтобы раствор слегка кипел. Жидкость станет коричневой, медная проволока постепенно растворится. CuSO4 + 4NaCl <=> Na2[CuCl4] + Na2SO4 Na2[CuCl4] + Cu => 2Na[CuCl2] Если раствор после травления вылить в большое количество воды, жидкость станет молочно-белой в результате осаждения CuCl: Na[CuCl2] => NaCl + CuCl Для ускорения травления имеет смысл барботировать через раствор воздух – чтобы окислить одновалентную медь. Также желательно подкислить раствор серной кислотой |

Осаждение хлорида меди CuCl в результате разбавления раствора, который образовался после травления меди смесью CuSO4 + NaCl |
_ iodide-preparation-1.jpg) |
Медь и кислоты - ч.5 Copper and acids В.Н. Витер | _ iodide-preparation-2.jpg) |
|
Получение иодида меди CuI
Иодид меди используется как индикатор для обнаружения паров ртути в воздухе. Получение этого соединения не представляет трудностей. Preparation of copper (I) iodide CuI Способ 1. CuSO4·5H2O растворяют в воде и при интенсивном перемешивании к раствору добавляют водный раствор соответствующих количеств KI и Na2S2O3·5H2O. Плотному белому осадку дают отстояться в течение ~15мин, а затем переносят на стеклянный фильтр. После промывания водой, этанолом и эфиром продукт измельчают и в течение нескольких дней сушат в вакууме над H2SO4. _ iodide-preparation-3.jpg) Путем обработки раствора CuSO4·5Н2O иодидом калия в присутствии незначительного избытка сернистой кислоты получают чисто-белый осадок, который сначала промывают водой с незначительным содержанием SO2, затем чистым спиртом без доступа воздуха и, наконец, безводным эфиром. После этого осадок сильно отсасывают и окончательно очищают от эфира в вакууме. Для удаления последних, упорно удерживающихся, следов воды продукт лучше всего нагреть в высоком вакууме сначала до 110°С, а затем немного выше 400°С. Рекомендуется добавить к продукту, высушенному при 110°С, некоторое количество иода, который при 400°С испаряется полностью. В случае если необходимо получить не вещество высокой чистоты, а индикатор для обнаружения ртути, сушка в вакууме не нужна. Вместо тиосульфата натрия или SO2 можно использовать и другие восстановители, например сульфит натрия. В крайнем случае, можно обойтись вообще без восстановителей: Однако, в этом случае иодид используется не рационально, а полученный CuI придется отмывать от иода органическими растворителями. |
_ iodide-preparation-7.jpg)
_ iodide-preparation-8.jpg)
_ iodide-preparation-9.jpg)
_ iodide-preparation-10.jpg)
_ iodide-preparation-11.jpg)
Осаждение иодида меди CuI. Для синтеза был использован технический CuSO4·5Н2O, поэтому полученный продукт окрашен в сероватый цвет. Это не мешает использовать CuI для обнаружения паров ртути |
 |
Можно ли проводить демеркуризацию порошком серы? Is it possible to carry out demercurization with sulfur powder? В.Н. Витер |  |
|
Среди части химиков прочно укоренилось мнение, что мелкие капельки ртути можно обезвредить с помощью порошка серы. Во многих книгах по технике безопасности сказано обратное - сера не обеспечивает эффективное удаление разлитой ртути. Несмотря на это, упомянутая точка зрения оказалась очень живучей - некоторые химики до сих пор рекомендуют коллегам применять для демеркуризации порошок серы.
|

|
|
Проведем эксперимент. Нальем в бюкс немного ртути.
|


Ртуть |
|
А теперь насыплем туда избыток мелкорастертой серы. К поверхности капель ртути сразу же прилипнут частички серы.
|
 
Ртуть и сера |
|
На следующий день капельки покроются черным налетом сульфида ртути, темные частички HgS будут заметны и среди порошка серы.
|


Взаимодействие ртути и серы: прошло 24 часа |
|
Со временем количество черного сульфида ртути будет увеличиваться, но это не должно вводить в заблуждение. Сульфидная пленка на поверхности ртути очень непрочная - при малейшем сотрясении она разрывается, обнажая блестящую поверхность металла (на фото показана стрелками). Кроме того, пары ртути прекрасно проникают через слой порошка серы [5].
|


Взаимодействие ртути и серы: прошло 20 дней |


Взаимодействие ртути и серы: прошло 60 дней |
|
Убедиться в том, что в бюксе присутствуют пары ртути очень просто. Насыплем в пластмассовую крышечку иодид меди [6] CuI и поставим ее в бюкс со ртутью и серой. Через некоторое время сероватый порошок CuI окрасится в ярко-оранжевый цвет. Это доказывает, что в бюксе присутствуют пары ртути, причем в опасных концентрациях. |

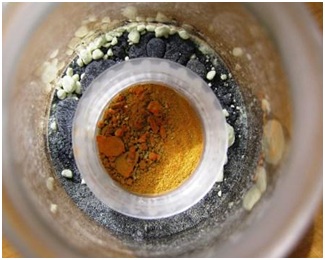
Сероватый порошок иодида меди при стоянии в закрытом бюксе со ртутью и порошком серы становится ярко-оранжевым. Это сигнализирует об опасной концентрации паров ртути |
|
Даже после двух месяцев контакта с порошком серы металлическая ртуть прореагировала лишь частично. Несмотря на избыток серы, ртуть продолжает активно испаряться. Сульфид HgS не образует прочной защитной пленки на поверхности капель ртути.
|

В бюкс со ртутью и порошком серы нальем крепкий раствор FeCl3 и поставим туда крышечку со свежим иодидом меди. Закроем бюкс. Даже через несколько суток цвет иодида меди останется без изменений - пары ртути не обнаружены |
|
Реакция ртути и серы проходит намного быстрее при растирании, однако во время демеркуризации применить такое воздействие нереально. На практике значительная часть разлитой ртути диспергируется до состояния мелких капелек и закатывается в щели и неровности поверхности.
Таким образом, применение серы для обезвреживания разлитой ртути недопустимо. Вместо серы следует использовать средства, которые доказали свою эффективность: раствор перманганата калия с добавкой соляной кислоты, хлорид железа (III), сульфид натрия. Как видно из последней фотографии, раствор хлорида железа (III) позволяет устранить образование паров ртути над поверхностью, где была металлическая ртуть. |

|